RESUMEN
El objetivo del presente trabajo fue evaluar el efecto que tiene el desarrollo temprano y su evolución hasta el final de la recría sobre los principales parámetros seminales de machos seleccionados por alta velocidad de crecimiento en el engorde. Para ello, se emplearon 179 conejas de la línea R durante 5 bandas, con un total de 1945 machos controlados al nacimiento, 1149 a los 63 días de vida y 550 a los 147 días de vida. Se controló el peso de los machos [al nacimiento (PN), 28, 63 y 147 días de vida]. Durante el testaje (4 semanas a partir del día 147) y su vida productiva (hasta 1.5 años), se controló individualmente la producción seminal y algunos parámetros de calidad seminal (volumen, motilidad, concentración, normalidad acrosómica y anormalidad), así como su riesgo y causa de eliminación en producción. El peso con el que nacen los futuros machos reproductores se ve influenciado negativamente por un mayor número de nacidos totales en su camada (-1.6 g por cada gazapo; P<0.001), y por el hecho de que su nacimiento tenga lugar en la época estival. Cuanto mayor fue el peso al nacimiento y menor el tamaño de su camada, mayor es su desarrollo al destete (+0.17 g/d por cada g o gazapo menos al nacimiento; P<0.001 y P=0.057, respectivamente) y hasta el momento de su selección a los 63 días de vida, viéndose éste también favorecido si se produce durante la primavera. Los resultados del presente trabajo ponen de manifiesto una mejora en las características seminales (+27% de concentración espermática en testaje y, +10 y -4% de volumen y eyaculados no aptos en producción, respectivamente; P<0.05) para los machos que nacieron con más de 72 g. Por otra parte, los animales que llegan al final de la recría con un excesivo peso vivo (>5100 g a los 147 días de vida) mostraron un mayor riesgo de eliminación durante la fase productiva que el resto de los animales (26.6 vs 15.7% para causa de baja muerte y 26.4 vs. 16.9% para causa de baja por enfermedades, respectivamente), y aunque debido a su mayor madurez parecen mostrar un mejor arranque durante la fase de testaje (-4.6% de espermatozoides anormales; P<0.05), su producción a largo plazo fue inferior a la obtenida por animales de un menor formato (-0.05 mL, -1% y +3.5% de volumen, motilidad visual y eyaculados no aptos, respectivamente; P<0.05).
1. INTRODUCCIÓN
La implantación producida en las últimas décadas de la inseminación artificial (IA) en las granjas cunícolas ha llevado consigo una mejora organizativa en el manejo de las explotaciones, incrementando el tamaño de las mismas y reduciendo el número de machos en la explotación, aunque su principal ventaja reside en la difusión del material genético.
Al mismo tiempo que se implantaba la inseminación artificial, la actividad investigadora para mejorar las técnicas de inseminación se hacía patente. Una muestra de ello son los estudios realizados con semen fresco, refrigerado y congelado (Castellini et al., 1990; Rebollar et al., 1992; Viudes de Castro y Vicente, 1996; Mocé, 2003), con la finalidad de evaluar sus características antes de su utilización y sus consecuencias en el sistema productivo de las granjas cunícolas. Por otra parte, y a nivel práctico, las valoraciones seminales se centran hasta el momento en descartar aquellos eyaculados que presentan una motilidad inferior al 70%, un porcentaje de formas anormales superior al 15% y/o un porcentaje de espermatozoides que muestran el acrosoma reaccionado superior al 20%, obteniéndose normalmente con estos controles resultados de fertilidad y prolificidad adecuados (Lavara et al., 2003).
Dentro del sistema productivo cunícola actual, cruce a tres vías, es el macho seleccionado por velocidad de crecimiento (VC) en el engorde el que más se ha visto involucrado en la implantación de la IA. Como consecuencia, tiene una gran importancia el desarrollo de estudios en los que se consideren como puede afectar el manejo y la alimentación durante el desarrollo de estos animales a su futura productividad seminal.
Estos machos seleccionados por alta VC en el engorde tienen una serie de peculiaridades reproductivas (inicio reproductivo tardío, menor deseo sexual, producción espermática baja,…) que hacen más importante si cabe la profundidad de su estudio. Así, y a modo de ejemplo, un estudio de Lavara et al. (2008) muestra una correlación genética positiva (+0.33) entre la anormalidad y la selección por VC en conejos.
En cuanto al manejo del macho en una granja, es importante optimizar los eyaculados producidos por animal que serán destinados a la inseminación artificial siendo, lo más recomendable para los machos seleccionados, la utilización de un ritmo de dos extracciones semanales (Lavara et al., 2003).
En cuanto a la evolución de la VC desde el nacimiento hasta la semana 40 de vida, Pascual (2002) apreció que los conejos seleccionados por VC en el engorde tienen unas necesidades nutricionales superiores a los animales procedentes de otras líneas (seleccionadas por otro criterio) o los procedentes del cruce a tres vías comercial. Así, estos animales mostraron una VC media de 54 g/d durante las 9 primeras semanas (63 días, fecha de sacrificio comercial en España), y durante el mes siguiente, los valores se mantienen aún elevados (40 g/d). A partir de la semana 12, el crecimiento disminuye llegando a valores de entre 0-10 g/d, siendo las necesidades nutricionales similares a causa del peso alcanzado. Estos animales pueden llegar a un peso incluso superior a los 6 Kg.
Recientemente, García-Tomas et al. (2008) estudiaron en machos de la misma línea genética, el desarrollo de su fisiología reproductiva, exponiendo que entre las 4 y 8 semanas, momento de mayor VC se observaba el mayor crecimiento testicular. Por otra parte, entre las semanas 8 y 14 observaron un mayor desarrollo del diámetro de los túbulos seminíferos que coincidía a su vez con la aparición de los lúmenes. A partir de la semana 14 de vida, en los lúmenes son visibles las espermátidas elongadas y entre las semanas 14 y 16 aparecen los espermatozoides en los túbulos.
Respecto a cómo el desarrollo durante la recría puede afectar a la producción espermática, Pascual et al. (2004) en un estudio con tres piensos de recría con diferente nivel de energía digestible (10.9, 12.3 y 13.5 MJ ED/kg MS para los pienso L, M y H respectivamente), describen que la época del año y el aporte de nutrientes durante la recría puede tener un importante efecto sobre la futura producción de los machos. En dicho trabajo se describe que aquellos machos que se recriaron con los piensos L y M en otoño, no llegaron a cubrir las necesidades proteicas en la primera parte de la recría, mostrando posteriormente una menor concentración y producción espermática que aquellos recriados con el pienso más concentrado (H). Sin embargo, en el caso de los animales que realizaron la recría en primavera, los machos alimentados con el pienso menos concentrado (L) mostraron una mayor concentración y producción espermática que los grupos M y H.
Aún así, son pocos los trabajos de investigación en cunicultura que tengan como objetivo el estudio del desarrollo temprano y su posible influencia con la calidad seminal en su futuro como productor de semen destinado a la IA. En hembras, Poigner et al. (2000), evaluando los efectos del tamaño de camada y el peso al nacimiento (PN) sobre la productividad futura de las conejas reproductoras, observan que las conejas con un mayor PN mostraron posteriormente un mayor tamaño de camada al parto (+12.4%) en sus primeros partos, respecto a las conejas que nacieron con un menor peso. En esa misma línea, Rommers et al. (2002) observan en conejas que a mayor peso al final de la recría mejor fueron los parámetros reproductivos en el primer ciclo, en términos de tamaño de camada, probablemente por su mayor grado de madurez.
Así, el objetivo del presente trabajo fue evaluar el efecto que tiene el desarrollo temprano y su evolución hasta el final de la recría sobre los principales parámetros seminales de machos seleccionados por alta VC en el engorde.
2. MATERIAL Y MÉTODOS
2.1. Animales
Para la realización del estudio, se emplearon 179 conejas de la línea R seleccionada por VC en el engorde en la Universidad Politécnica de Valencia (UPV) y localizadas en la granja “El Adil” en Carrizo de la Ribera (León).
Las conejas del estudio se controlaron durante 5 bandas (consecutivas y equidistantes) en el momento del parto, desde el 23 de Febrero de 2008 hasta el 6 de Septiembre de 2008, siendo inseminadas 31 días antes con machos de la misma línea genética. Se controlaron un total de 1945 machos al nacimiento y 1149 machos al momento de su selección a los 63 días de vida y 550 machos durante su testaje (4 primeras semanas de monta) y 1.5 años de vida productiva.
2.2. Procedimiento experimental
Las camadas fueron sexadas el mismo día del parto con el fin de identificar a los machos del estudio. Los machos se pesaron individualmente con una balanza Ohaus Pioneer (precisión: 0.01 g). Se anotó si los gazapos habían mamado ya leche (mancha láctea), y se les inyectó un chip de identificación de 2 x 12 mm (EI1001, Felixcan S.A.) en la parte posterior del cuello, mediante una aguja desinfectada en iodo y una jeringa con un embolo impulsor. Tras introducirles el chip se devolvieron con el resto de la camada. El número de parto de la coneja al que correspondía la camada, el número de nacidos vivos y muertos también fue registrado.
A los 28 días de vida, los gazapos eran sexados nuevamente, leyéndoles el chip a los machos e identificándoles con un tatuaje de tinta auricular para, a continuación, pesarlos en una balanza Mettler con una precisión de 5 g. A los 36 días se destetaron llevando a la madre a una sala adjunta y dejando a la camada en la misma jaula en la que nacieron.
A los 63 días de vida, se volvió a pesar a todos los machos. En este punto, se producía la selección de los machos que iba a ser mantenidos en los núcleos de machos. Dicha selección se realizó a partir de los pesos e incrementos de peso correspondiente a cada uno de ellos, con el fin de elegir de todos los machos aquellos que nos permitiese construir una población que recogiera la máxima variabilidad posible en lo que se refiere a posibles diferentes desarrollos tempranos, considerando en dicha selección los pesos al nacimiento, destete y fin de engorde.
Una vez seleccionados los futuros machos a mantener en el estudio, se destinaban de forma equitativa (considerando mantener dicha variabilidad de desarrollos) a dos destinos diferentes. La mitad del lote se quedaba en el núcleo de machos contiguo del “Adil” en Carrizo de la Ribera (L) y la otra mitad a “Zapiños” núcleo del mismo grupo en Abegondo, A Coruña (G).
El período de recría duró hasta el día 147 de vida de los machos. En este momento se pesó a los animales por última vez y durante las 4 semanas siguientes se realizó el testaje, consistiendo en la recuperación de un eyaculado por semana con la utilización de una vagina artificial. Durante la fase de testaje se controló para cada uno de los animales el número, volumen, motilidad, concentración, producción de eyaculados, así como la normalidad acrosómica y la anormalidad de sus espermatozoides.
Por otra parte, se controló la vida productiva de cada macho durante 1.5 años a partir del seguimiento de las bases de datos que tienen los núcleos para el seguimiento y control de los animales, extrayendo de ellas los parámetros productivos hasta la fecha de su muerte o sacrificio: vida productiva, calculada como los días de permanencia del animal en el núcleo desde el final del testaje a su eliminación, fecha de eliminación, la causa de eliminación, número de extracciones en la vida productiva por animal, así como el número, volumen, motilidad, aspecto, concentración y aptitud de los eyaculados. El semen se recuperó de forma individual, realizando entre 2 y 4 montas semanales.
2.3. Piensos
Tabla 1. Características de los piensos utilizados durante toda la experiencia (información obtenida a partir del etiquetaje de los piensos comerciales)
Las características de los piensos utilizados durante todo el experimento se muestran en la Tabla 1. Los animales consumieron el pienso de madres hasta el día 30 de vida. Durante los 6 días previos al destete, los gazapos y la hembra comen el pienso de peridestete para que la transición al pienso de crecimiento sea mejor y los problemas entéricos frecuentes en estas edades disminuyan. Una vez destetados los animales, la camada recibió el pienso de crecimiento hasta el día 63. A partir de dicho momento y hasta el día 147 de vida los machos comieron el pienso de recría caracterizado por su mayor contenido en fibra bruta (17.5%). A partir de ese momento y a lo largo de su vida productiva los machos recibieron un pienso de recuperación.
2.4. Evaluación de semen
2.4.1. Fase de testaje
Los machos fueron testados durante 4 semanas consecutivas tras el pesaje a 147 días de vida. Esta fase es importante ya que sirve en los núcleos como criterio para seleccionar los futuros machos reproductores. El semen se recuperó de forma individual y con una sola monta semanal.
De los eyaculados recogidos, se descartaron aquellos que tenían orina y de los restantes, se observaba primeramente si contenían gel, extrayéndolo para evitar aglutinamientos. El volumen de los eyaculados seleccionados se determinaba mediante un tubo graduado (±0.01 mL). Se cogió una pequeña alícuota del eyaculado y se diluyó 1:5 con diluyente Tris-cítrico-glucosa para poder valorar su motilidad visual y calidad de forma subjetiva por la encargada del centro.
Una vez valorado, se introdujeron 100 μL de semen en un eppendorff con 900 μL de glutaraldehido para la conservación del semen. Los eppendorffs con las muestras se enviaron a la UPV para realizar los análisis de concentración, normalidad acrosómica y formas anormales.
Para la valoración de la concentración, se cogieron de cada muestra 10 µL de eyaculado con glutaraldehido, que anteriormente fueron agitados en vortex para asegurarse de una correcta homogeneización de la muestra. Ésta se diluyó en 50 µL de una solución tampón fosfato salina Dulbecco con glutaraldehido al 0.25 %. Tras agitar el eppendorff con la muestra diluida 1:6, se llenó la cámara Thoma-Zeiss con una pipeta Pasteur de vidrio, por capilaridad. Para el análisis se utilizó un microscopio Nikon Eclipse E400 con una óptica de contraste de fase a 40x. Visualizando por el microscopio, se procedió al contaje de los espermatozoides (spz) que había en dos diagonales (40 cuadros). Se contaron los espermatozoides que tienen la cabeza dentro del cuadro, contando también, las cabezas que quedaron encima de dos líneas de las que forman el cuadro. La concentración fue hallada mediante la siguiente fórmula:
spz/mL = n° spz (en 40 cuadros) x 100.000 x 1/D
siendo D la dilución del eyaculado y n° spz el número de espermatozoides contados en los 40 cuadros. El resultado se expresa en espermatozoides por mililitro. Una vez se tiene la concentración, multiplicándose por el volumen, se halló la producción espermática por eyaculado.
Para la valoración del estado del acrosoma y la anormalidad, se utilizó 10 µL de muestra y 10 µL de tinción eosina-nigrosina, mezclándose ambos en un porta mediante una micropipeta, para posteriormente arrastrar la gota resultante con otro porta para conseguir una fina película. Se dejaba secar durante 24 horas y se le depositaba un cubre fijandolo con pegamento de montaje. Para su análisis se utilizó un microscopio LEICA DME con óptica de campo claro de 40x, contándose al menos 100 espermatozoides diferenciando entre aquellos con acrosoma normal o dañado, y aquellos con forma normal o anormal. Para la realización de los cálculos se utilizaron las siguientes expresiones:
% Acrosomas normales = Acrosomas normales / (Acrosomas Normales + Acrosomas Dañados)
% Spz anormales: Spz Anormales / (Spz Anormales + Spz Normales)
2.4.2. Fase de producción durante 1.5 años
De los machos que llegaron a esta fase se midieron los siguientes parámetros: vida productiva, calculada como los días de permanencia del animal en el núcleo desde el final del testaje a su eliminación, muerte o fin; fecha de eliminación; causa de eliminación (muerte, enfermedad, baja productividad), destino del animal (L o G); número de extracciones en la vida productiva por animal (número de veces que se lleva a la monta); volumen, en tubo graduado (±0.1 mL), de aquellos eyaculados que se consideraban aptos; número de eyaculados. Además se controlaron ciertos parámetros de evaluación subjetiva correspondientes a cada eyaculado, como aspecto [normal o no válido (amarillo, orina, pasta, gel, precipitados o sangre)], concentración (alta, normal, baja o nula); aptitud del eyaculado (apto y no apto; siendo apto cuando la concentración es alta o normal y de aspecto normal, no apto cuando la concentración era baja o nula y de aspecto normal), motilidad visual en microscopio de cada eyaculado, diluyéndolo 1:5 con un diluyente tris-cítrico-glucosa de uso habitual para esperma de conejo, de aquellos eyaculados considerados como aptos.
Por otra parte, se calcularon el porcentaje de eyaculados en relación al número de veces que se llevaba a la monta, los porcentajes para cada tipo de aspecto y aptitud de los eyaculados, así como la motilidad y el volumen medio para los eyaculados aptos.
2.5. Análisis estadístico.
Para la corrección de peso de los gazapos al nacimiento en función o no de la presencia de mancha láctea (importante factor sobre el peso del animal en el momento del control al parto), se hizo un estudio sobre los 120 gazapos recién nacidos de la línea R de la granja de Mejora Genética de la UPV, a los cuales se les pesaba recién nacidos, distinguiendo los que tenían mancha de los que no y, volviéndolos a dejar en el nido pero cerrándole la entrada a la madre. Al día siguiente, se pesaba a la madre antes de la lactación y después, y de la misma manera a los gazapos. Mediante un procedimiento PROC REG de SAS (2002) se obtuvo una ecuación para estimar la parte del peso del animal atribuible a la mancha láctea en el día del parto (MCH), en función del número de nacidos en la camada (NNV) y el peso del gazapo al parto con mancha (PD0) hallándose la siguiente fórmula:
MCH(g)= (-9.48717 + 0,23945 x PD0 + 0,30287 x NNV)
, y determinando el peso del gazapo corregido al parto (PD0C) de los machos que si habían mamado como,
PD0C= PD0-MCH
Para el análisis de los principales factores que afectaron al desarrollo temprano (PN y velocidades de crecimiento en lactación, engorde y recría) se utilizó un procedimiento GLM de SAS (2002), donde el modelo incluyo la época de nacimiento (5 niveles) y el número de parto (del 1 al 16) como efectos fijos, así como la madre como efecto aleatorio. Para el análisis del PN se introdujo el número de nacidos totales como covariable. En el caso de las velocidades de crecimiento se introdujeron como covariables el PN y el número de nacidos totales. El efecto de las covariables se determinó mediante análisis de contrastes (ESTIMATE de SAS, 2002).
Una vez obtenidos todos los datos de los pesos y para realizar el posterior análisis estadístico, se estratificó la población de forma equilibrada en función del PN, el peso al final de la recría (PFR), e incremento de peso en lactación, engorde y recría. Para realizar dicha estratificación se tuvo en cuenta los cuantiles de cada factor de clasificación, así como el equilibrio de las posibles interacciones (Véase Tabla 2).
La población de machos utilizada durante la fase de testaje y producción se describió estadísticamente mediante un procedimiento MEANS de SAS (2002). Los parámetros seminales medios controlados durante la fase de testaje y producción fueron analizados mediante un procedimiento GLM de SAS (2002), donde el modelo incluyo como efecto fijos los grupos de estratificación (PN y PFR, o los incrementos de peso en lactación, engorde y recría), la época del año del nacimiento (5 niveles) y el núcleo de destino de los machos (Carrizo o Abegondo), y como efecto aleatorio la coneja. Para el estudio del efecto de los crecimientos durante el desarrollo sobre los parámetros seminales se introdujo como covariable el PD0C.
Para el análisis del efecto de los principales factores de desarrollo sobre la vida productiva durante 1.5 años de los animales que fueron introducidos en los núcleos de selección se utilizó un análisis de supervivencia (STATGRAPHICS Centurion) utilizando una función de riesgo semi-paramétrica de Cox, mediante el modelo,
hi(t|xi) = h0(t) x exp (xi(t)β)
Donde hi(t|xi) es la función de riesgo del animal i al tiempo t, h0(t) es la línea base de la función de riesgo a tiempo t, xi es vector para el animal i que relaciona las covariables a las observaciones, las cuales pueden ser dependientes o independientes del tiempo, β es el vector de los coeficientes para las covariables. Se introdujeron varias covariables (PN, PFR, velocidad de crecimiento en las distintas fases del desarrollo, época del año), para evaluar el riesgo relativo de eliminación en función del diferente desarrollo temprano, pero sólo se mantuvo aquellas significativas en el modelo (PFR). Los datos incluyeron 150 datos censurados (44%; llegaron a fin del experimento, 1.5 años, sin ser eliminados) y 227 datos no censurados (66%; fueron eliminados antes del fin del experimento).
3. RESULTADOS Y DISCUSIÓN
3.1. Factores que afectan al desarrollo temprano
En la Figura 1 se muestra el efecto del número de nacidos totales, el número de parto y de la época del año donde tiene lugar el nacimiento sobre el peso con el que nacen los futuros machos reproductores de la línea R.
Como se puede observar en la Figura 1a, existe un claro efecto del número de nacidos totales sobre el PN. Por cada gazapo más nacido en la camada el peso individual de los machos se redujo en 1.6 g (R2 = 0.91; P<0.001). En este mismo sentido, muchos otros autores (Lebas, 1982; Pálos et al., 1996; Poigner et al., 2000a) han mostrado anteriormente que a mayor tamaño de camada se disminuye el PN, debido probablemente a la mayor competencia de nutrientes durante el desarrollo fetal.
En la Figura 1b, observamos que el efecto que tiene el número de parto sobre el PN es similar a lo observado en la mayoría de especies multíparas (cerdas: SalmonLegagneur, 1958; conejas: Sabater et al., 1993). En el primer parto, el PN es bajo debido fundamentalmente a que el animal aún no tiene un formato adulto. Entre el 2º y 5º parto el PN es bajo debido que en esos primeros ciclos el número de nacidos en la camada es superior. A partir de entonces, el PN es mayor, esto puede ser debido a un mayor tamaño de la coneja y a una tendencia a reducirse el tamaño de la camada al parto con la edad (Theilgard et al., 2007). De hecho, podemos observar como cuando las hembras tienen un número muy elevado de partos (a partir del 14º) el PN disminuye, probablemente ligado a un agotamiento de la hembra.
Por otra parte, uno de los factores más importantes que influyen en el PN es la época del año como se puede observar en la Figura 1c, donde se muestra una tendencia a la disminución del PN de los machos con el aumento de la temperatura de invierno a verano, probablemente relacionado con una menor disponibilidad de nutrientes para el crecimiento fetal vinculado a la frecuente reducción de la ingestión de las conejas reproductoras con el aumento de la temperatura (Cervera y FernándezCarmona, 2010) .
En cuanto a la influencia que tiene el PN y el tamaño de camada sobre el posterior desarrollo de los machos (Tabla 3), los animales que nacen con un mayor peso y/o pertenecen a camadas menos numerosas presentan una mayor velocidad de crecimiento en lactación [+0.17 g/día por cada g más de PN (P<0.001) y -0.17 g/d por cada gazapo nacido más en la camada (P<0.10)]. Esto puede ser debido probablemente a una mejora de la competitividad del animal por la leche de la madre (Szendrö, 1986; Poigner et al., 2000a). La época del año también tiene su influencia, siendo los animales nacidos en primavera los que mayor velocidad de crecimiento muestran en lactación, probablemente debido a un menor gasto de mantenimiento y una mayor capacidad de ingestión de la madre, lo que influye positivamente en la producción de leche (Figura 2a). Figura 1. Evolución del peso al nacimiento en función del número de nacidos totales, número de parto y de la fecha de nacimiento.
3.2. Descripción de la población testada
En la Tabla 4 se muestran las principales características descriptivas tanto de desarrollo temprano como seminales de aquellos animales que se seleccionaron para el estudio.
Observamos que el rango de PN (34 a 102 g) cumple ampliamente con el objetivo de tener la mayor variabilidad de animales para dicha variable en el estudio, teniendo un coeficiente de variación (CV) del 20%. Si bien este CV se ve reducido en el peso a los 63 días, al inicio de la fase de testaje la variabilidad del peso de estos animales estuvo en torno al 25%.
Si comparamos estos datos con los mostrados en un estudio previo (Pascual et al., 2004) con animales de esta misma línea genética (R), se observa que los animales de nuestro estudio tienen un mayor peso y velocidad de crecimiento, si bien esto puede ser debido a una diferencia de 7 años de selección y distinta área geográfica. En cuanto a los parámetros seminales en las primeras semanas (testaje), los valores de nuestro estudio fueron inferiores a causa, probablemente, de una diferencia de edad (4.5 vs. 5.5 meses) y velocidad de crecimiento. De hecho, en la fase de producción aumenta el volumen y el porcentaje de eyaculados, acercándose a los valores obtenidos por Pascual et al. (2004).
3.3. Efecto del desarrollo temprano sobre la producción seminal en la fase de testaje
En la Tabla 5 se muestra el efecto que tuvo el PN y el peso con que los machos llegan al final de la recría sobre los principales parámetros seminales controlados durante la fase de testaje. De estos resultados merece la pena destacar que aquellos machos que nacieron con un mayor peso fueron los que mostraron una mayor concentración de espermatozoides, especialmente respecto a los de PN medio-alto (de media +27%; P<0.05). Este valor de concentración tiene su reflejo en la producción espermática, aunque no de forma significativa.
Existen muy pocos trabajos en los que se haya estudiado el efecto del desarrollo durante la fase embrionaria sobre la futura actuación como animal productor de semen. Sin embargo, Iczkowoski et al. (1991) observa que el mayor desarrollo del volumen testicular ocurre durante las primeras semanas de vida. Por otra parte, en hembras multíparas (Conejas: Poigner et al., 2000a; ratonas: Falconer, (1955, 1960), Nelson y Robinson, 1976; cerdas: Van-der Steen, 1985 y Horn et al., 1987) se observa que un menor PN y/o un peor desarrollo temprano, supone una futura desventaja reproductiva. Por ejemplo, Poigner et al. (2000a) observa que aquellas conejas que muestran un menor PN, tienen un menor tamaño de camada en sus dos primero partos.
Respecto al PFR, el semen de los machos cuyo peso fue bajo, mostró un mayor volumen (P<0.05) respecto a los grupos medios. Por otro lado, el grupo de PFR alto obtuvo un menor porcentaje de espermatozoides anormales y diferente significativamente (P<0.05) respecto a los grupos medios. Esto puede ser debido a una mayor madurez del animal en el momento del testaje. En otros estudios como el de Rommers et al. (2002) se observa que a un mayor PFR mejora la primera paridera en términos de tamaño de camada en conejas reproductoras, y también lo relaciona con una mayor madurez de éstas.
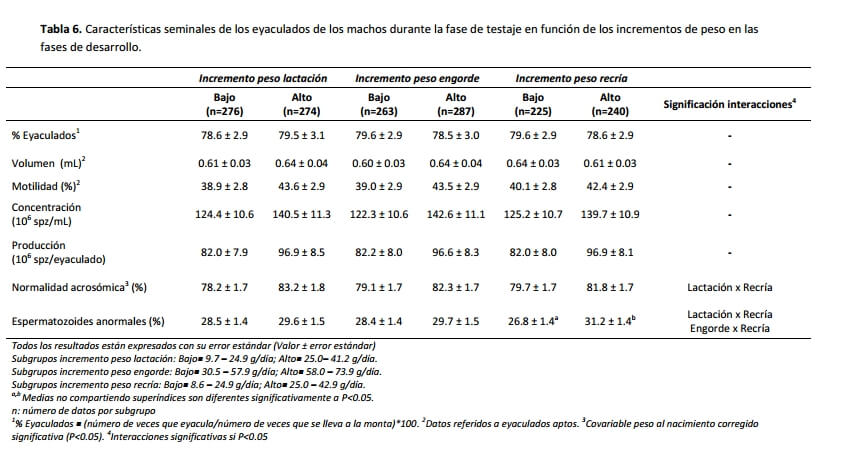
Para analizar cuál de las fases de desarrollo (lactación, engorde y/o recría) pueden ser responsables de estos resultados obtenidos en función del PFR, la influencia de la velocidad de crecimiento en las diferentes fases de desarrollo sobre los parámetros seminales se muestra en la Tabla 6. Se observa que aquellos machos con menor crecimiento en las diferentes fases dan valores inferiores de normalidad acrosómica. En la Figura 3a, se describe la interacción triple entre los incrementos para la normalidad acrosómica, observándose que la diferencia viene dada por el hecho de que los machos que mostraron un crecimiento bajo en todas las fases son los que mostraron el menor % de normalidad acrosómica en su semen, aunque también fueron los que presentaron un menor porcentaje de espermatozoides anormales (P<0.05).
Figura 3. Representación de la interacción triple de los diferentes crecimientos tempranos (lactación, engorde y recría) sobre los valores de acrosomía y formas anormales de los eyaculados durante la fase de testaje.
En cuanto a la relación de las diferentes fases de desarrollo con el porcentaje de formas anormales en el testaje, se observa que los grupos de incremento bajo mostraron valores inferiores siendo significativo (P<0.05) en el caso del período de recría. Esto puede estar relacionado con lo descrito por Lavara et al. (2008) que observa una correlación genética positiva (+0.33) entre la anormalidad y la selección por VC en esta misma línea.
3.4. Efecto del desarrollo temprano sobre la producción a largo plazo
Una de las variables más importantes a la hora de valorar la producción de un animal reproductor a largo plazo es el riesgo de eliminación (Figura 4). Para ello se estudió la duración productiva de los machos con datos censurados hasta 1.5 años de vida. A su vez, se valoraron las causas de muerte para cada una de las variables del estudio (pesos e incrementos).
Figura 4. Riesgo de eliminación en función del peso al final de la recría.
Aquellos machos con un mayor riesgo de eliminación correspondían a los de mayor PFR, siendo mínimo dicho riesgo para aquellos animales que había tenido un buen desarrollo (medio-alto) pero no excesivo. El porcentaje de animales con alto PFR que llegaron a 1.5 años fue del 28 %, siendo para el del resto de grupos del 43% de media. Si analizamos las causas de baja, los machos con alto PFR, mostraron una mayor incidencia de baja debidas tanto a muerte como por enfermedades respecto a la media de los otros 3 grupos (26.6 vs 15.7 para causa de baja muerte y 26.4 vs. 16.9 para causa de baja por enfermedades, respectivamente). Estos resultados coinciden con aquellos obtenidos por Theilgaard et al. (2007) para conejas reproductoras durante 6 ciclos reproductivos. En dicho trabajo, los autores muestran que las conejas tendrían un nivel de engrasamiento óptimo que reduciría el riesgo de eliminación, aumentando dicho riesgo a medida que la condición corporal se alejase dicho nivel óptimo.
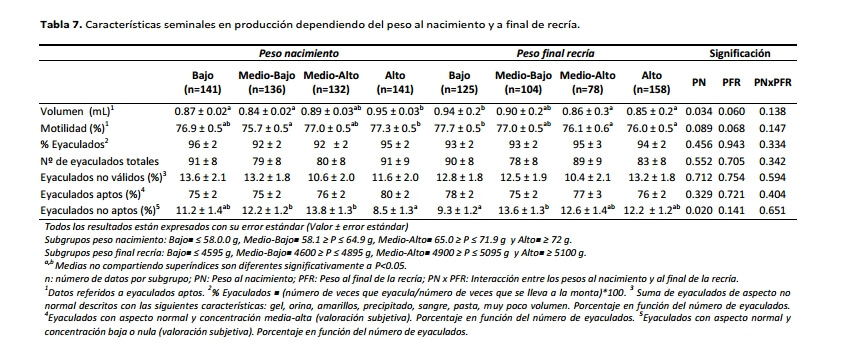
Respecto al efecto del desarrollo temprano de los machos sobre la productividad a largo plazo, y como se puede ver en la Tabla 7, los animales que nacieron un peso superior a los 72 g tuvieron eyaculados con un mayor volumen medio (+10%; P<0.05), que aquellos que nacieron con un peso inferior a los 65 g. Además sus eyaculados fueron los que mostraron los mejores valores de motilidad (P<0.05) y de eyaculados no aptos de forma significativa (P<0.05). De nuevo, y al igual a lo observado previamente por otros autores (Szendrö et al., 1989; Biró-Németh y Szendrö, 1990; Poigner et al., 2000b), los animales procedentes de camadas menos númerosas o que nacen con un mayor PN son las que presentan posteriormente una mejor respuesta reproductiva.
En contraposición al PN, los machos que llegan al final de la recría con un mayor peso (subgrupos medio-alto y alto) mostraron menores volúmenes y motilidad que el subgrupo de menor peso (P<0.05). Este último, a su vez, mostró los porcentajes más bajos de eyaculados no aptos respecto al resto de grupos y de forma significativa (P<0.05) que el subgrupo medio-bajo. Los animales de mayor peso (probablemente más engrasados) parecen mostrar una menor eficacia reproductiva a largo plazo, sin poder atribuirle a ninguna de las fases este hecho. Pascual et al. (2004) también observa que, cuando se utilizan piensos altamente energéticos durante la recría de machos en épocas del año donde los animales no tienen restricciones en su ingestión, los machos mostraron unos peores parámetros seminales durante las primeras semanas de producción espermática.
Si observamos la Tabla 8, en lo referente a las diferentes bandas y su relación con la producción, los machos que se desarrollan en primavera-verano (bandas 1 y 2), mostraron un menor volumen (0.83 mL de media) respecto de los machos de los lotes de otoño-invierno (bandas 4 y 5 con una media de 0.94 mL; P<0.05). Esto parece confirmar los datos de Pascual et al. 2004, en los que los animales de recría en otoño mostraron mayores volúmenes de eyaculados. La misma dinámica que para el volumen se observa en el porcentaje de eyaculados no aptos.
Tabla 8. Características seminales en el testaje y producción en función de la fecha de nacimiento y de inicio de testaje.
3.5. Efecto de la fecha al nacimiento sobre la producción seminal
Por último, en la Tabla 8 se muestra la influencia que tienen tanto la fecha de nacimiento como su fecha de entrada en la fase reproductiva sobre los parámetros seminales controlados en el testaje y en la fase de producción. Podemos observar que aquellos machos que vienen de una recría en verano (bandas 2 y 3) muestran peores valores en la mayoría de las variables controladas durante el testaje (P<0.05): motilidad (27.5 vs. 47.7%), concentración espermática (78.3 vs. 161.1·106 spz/mL) y producción espermática (50.5 vs. 108.2·106 spz/eyaculado), respecto a la media observada para las bandas 1, 4 y 5. La razón de este resultado puede justificarse por el hecho de que la espermatogénesis dura 49 días y coincidiría con la fase estival.
También podemos observar que aquellos animales nacidos en verano (Banda 4) y cuyo crecimiento fue bajo en las primeras fases de desarrollo (Figura 2a y 2b) tienen valores inferiores de porcentaje de eyaculados, debido probablemente a una menor madurez corporal a la edad de testaje. Gunn et al. (1995) observó en conejas que aquellas que tenían un bajo peso en el periodo fetal o en las primeras fases de vida veían reducidas sus capacidades reproductivas.
4. CONCLUSIONES
El peso con el que nace los futuros machos reproductores se ve influenciado negativamente por un mayor número de nacidos totales en su camada y por el hecho de que su nacimiento tenga lugar en la época estival. Del mismo modo, cuanto mayor es el peso al nacimiento y menor el tamaño de su camada, mayor es su desarrollo hasta el momento de su selección a los 63 días de vida, viéndose éste también favorecido si se produce durante la primavera.
Los resultados del presente trabajo ponen de manifiesto una mejora en la producción seminal de los machos seleccionados por velocidad de crecimiento en el engorde al aumentar su peso al nacimiento. Así, los mejores valores para la concentración espermática en la fase de testaje, y de volumen, motilidad y porcentaje de eyaculados no aptos durante la fase de producción fueron obtenidos para los machos que nacieron con más de 72 g.
Por otra parte, los animales que llegan al final de la recría con un excesivo peso vivo (>5100 g) mostraron un mayor riesgo de eliminación por muerte y/o enfermedad durante la fase productiva, y aunque debido a su mayor madurez parecen mostrar un mejor arranque durante la fase de testaje, su producción a largo plazo fue inferior a la obtenida por animales de un menor formato.
5. BIBLIOGRAFÍA
BIRÓ-NEMETH, E., SZENDRO, ZS. 1990. “Reproductive performance of does suckled in different size litter (in Hungarian)”. En: 2nd Hungarian Conference on Rabbit Production Kaposvar, 63-69.
CASTILLENI, C., FACCHIN, E. y CANCELLOTI, F.M. 1990. “Difussion de l’I.A: chezles élevages de lapins en Italie: résultats, problématiques et perspectives”. En: Proc. de la 5émes Journées de la Recherche Cunicole, 12 et 13 Décember, París, France. Com. 5, 8 pp.
CERVERA, C., BLAS, E., FERNANDEZ-CARMONA, J. 1997. “Growth of rabbits under different environmental temperatures using high fat diets”. World Rabbit Science, 5(2):71-75.
CERVERA, C., FERNÁNDEZ-CARMONA, J. 2010. “Nutrition and the climatic environment”. En: Blas, C., y Wiseman, J., Nutrition of the rabbit 2 nd edición, London, UK, pp. 276-284.
CHIERICATO, G.M., BOITI, C., CANALI, C., RIZZI, C., RAVAROTTO, L. 1995. “Effects of heat stress and age on growth performance and endocrine status of male rabbits. World Rabbit Science, 3(3):125-131.
FALCONER, D.S. 1955. “Pattern of response in selection experiment with mice”. Cold Spring Harbor Symp. Quant Biol. 20: 178-196.
FALCONER, D.S. 1960. “The genetics of litter size in mice”. J. Cell. Comp. Physiol. 56: 153-167. GARCÍA-TOMÁS, M., SÁNCHEZ, J. y PILES, M. 2008. “Postnatal sexual development of testis and epididymis in the rabbit: Growth and maturity patterns of microscopic markers”. Theriogenology 71: 292-301.
FERNÁNDEZ, J., CERVERA, C., BLAS, E. 1994. “Efecto de la inclusión de jabón cálcico en el pienso y de la temperatura ambiental sobre el crecimiento de conejos”. Inv. Agrária: Prod. San. Animales. 9(1): 5-11.
GUNN, R.G., SIM, D., HUNTER, E.A. 1995. “Effects of nutrition in utero and in early life on the subsequent lifetime reproductive performance os Scottish Blackface ewes in two management systems”. Animal science, 60, 223-230.
ICZKOWSKI, K.A., SUN, E.L. y GONDOS, B. 1991. “Morphometric study of the prepuberal rabbit testis: germ cell numbers and seminiferous tubule dimension”. Am. J. Anat.; 190: 266- 72.
HORN, P., KOVACH, G., CSATO, L., BALTAY, M. y URECZKY, J. 1987. “The effect of newborn litter size on the reproductive performance of offspring in sows (in Hungarian)”. En: Proc. of the 1st Hungarian Genetic Conference, Budapest, 120 p.
LAVARA, R., GARCÍA, M.L., TORRES, C., VICENTE, J.S. y BASELGA, M. 2008. “Genetic parameters for semen traits of rabbit males: I Production, morphologic, and sperm head morphometry”, En: Proc. of the 9th World Rabbit Congress, Verona, Italia, 153-157.
LAVARA, R., MOCÉ, E. y VICENTE, J.S. 2003. “Buena práctica de inseminación artificial: I. Preparación de dosis seminales. Los factores responsables de la variación de los resultados de fertilidad y prolificidad de la IA”. Boletín de Cunicultura; 128: 14- 23.2003.
LEBAS, F. 1982. “Influence de la position in utero sur le dévelopment corporel des laperaux”. En: Proc. of the 3èmes Journ. Rech. Cunicole, Paris.
NELSON, E. y ROBINSON, R.K. 1976. “Effects of postnatal maternal environment on reproduction of gilts”. En: Pro. of the Journal Animal Science, 43: 71-77.
PÁLOS, J., SZENDRÖ, ZS., KUSTOS, K. 1996. “The effect of number and position of embryos in the uterine horns on their weigth at 30 days of pregnancy”. En: Proc. of the 6th World Rabbit Congress, Toulosse, Vol. 2, 97-102.
PASCUAL, J.J. 2002. “Nutrición de machos destinados a inseminación artificial”. En: Proc. de las II Jornadas Internacionais de Cunicultura, Vila Real, Portugal, 2002: 197-212.
PASCUAL, J.J., GARCÍA, C., MARTÍNEZ, E., MOCÉ, E., VICENTE, J.S. 2004. “Rearing management of rabbit males selectec by high growth rate: the effect of diet and season on semen characteristics”. En: Reprod. Nutr. Dev. 44, 2004 :49-63
POIGNER, J., SZENDRÖ, ZS., LÉVAL, A., RADNAI, I., BIRÓ-NÉMETH, E. 2000a. “Effect of birth weight and litter size on growth and mortality in rabbits”. World Rabbit Science, 8(1):17-22.
POIGNER, J., SZENDRÖ, Z., LÉVAI, A., RADNAI, I. y BIRÓ-NEMETH, E. 2000b. “Effect of birth weight and litter size at suckling age on reproductive performance in does as adults”. World Rabbit Science. 8(3): 103-109.
REBOLLAR, P.G., UBILLA, E., RODRIGUEZ, J.M. 1992. “Influence of the parturition-insemination interval on the conception rate in rabbits artificial inseminated with fresh semen”. J. Appl. Rabbit Res., 15: 407-411.
ROMMERS, J.M., MEIJERHOF, R., NOORDHUIZEN, J. P. T. M. Y KEMP, B. 2002. “Relationships between body weight at first mating and subsequent body development, feed intake, and reproductive performance of rabbit does”. En: Pro. of the Journal Animal Science. 80: 2036-2042.
SALMON-LEGAGNEUR, E. 1958. “Observations sur la production laitière des truites”. Ann. Zootech., 7: 95-143-162.
SAS 2002. SAS/SAT User’s Guide (Release 9.1). SAS Inst. Inc. Cary NC, USA.
STATGRAPHICS Centurion. STATGRAPHICS Centurion XVI User Manual. Statpoint Technologies, inc. 2010
SZENDRÖ, ZS. 1986. “Evaluation of the productive traits of rabbits from aspect of genetic improvement”. PhD Thesis, Gödöllo.
SZENDRÖ, ZS., LANG, M., SZABO, J. 1989. “Performance of does in dependence of litter size in which they were born”. En: Allattenyesztés és takarmányozás. 38: 159-164.
THEILGAARD, P., SÁNCHEZ, J.P., PASCUAL, J.J., BERG, P., FRIGGENS, N., BASELGA, M. 2007. “Late reproductive senescense in a rabbit line hyper selected for reproductive longevity, and its association with body reserves”. Genet. Sel. Evol. 39: 207–223. Versión 16-1-03.
SABATER, C., TOLOSA, C., CERVERA, C. 1993. “Factores de variación de la curva de lactación de la coneja”. Arch. Zootec., 42: 105- 1 14.
VAN DER STEEN, H. A. M., 1985. “Maternal influence mediated by litter size during the suckling period on reproduction traits in pigs”. Livest. Prod. Sci., 13: 147-158.
VIUDES DE CASTRO, M.P. y VICENTE, J.S. 1996. “Effect of sperm count on the fertility and prolificity rates of meat rabbits”. Animal Reproduction Science, 46: 313-319.
VIUDES DE CASTRO, M.P., VICENTE, J.S., LAVARA, R. 1999. “Effect du nombre de spermatozoïdes sur fertilité de la semence conservée 24 heures chez le lapin” Annales de zootechnie, 48: 407-412.











Un comentario en «Efecto del desarrollo temprano sobre la producción seminal a largo plazo en conejos seleccionados por velocidad de crecimiento en el engorde»
Muy buen post. Gracias por compartirlo.